您暂未开通校网通服务
校网通是什么
学校一次性购买1000万套海量教学资源,全校教师24小时免费下载。
校网通专属VIP权益
校园内高速免学币下载网站的普通点/精品资料;
学校形象展示及校领导、教师形象;
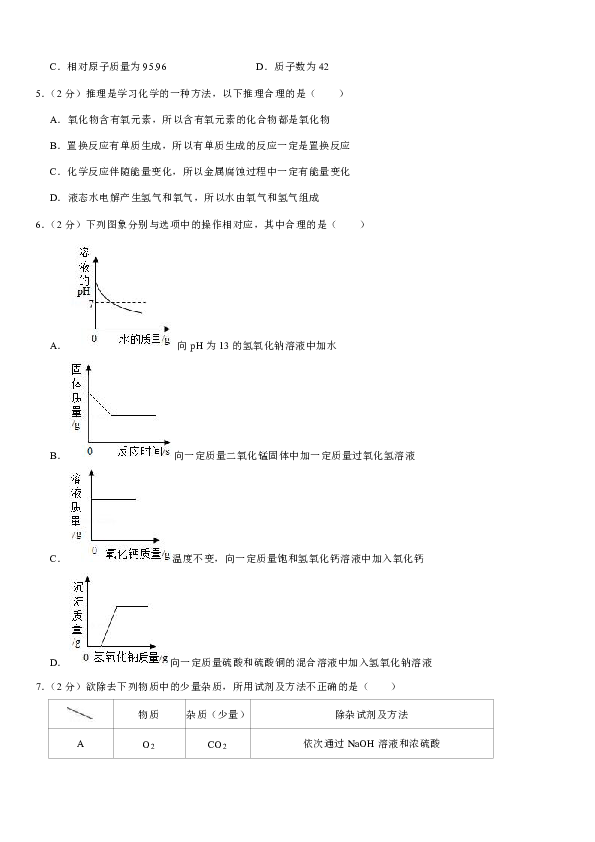
专享千余所名校独家内部资源;
个性化定制,征集成体系汇编源;
专属客服全程对接;
资源ID:6532129; 学科:化学; 学段:初中; 类型:普通资料; 用户ID:; 用户名:; 用户组ID:; IP:3.17.28.48; 时间:2024-04-19 21:43:48 code:0
【点击复制】